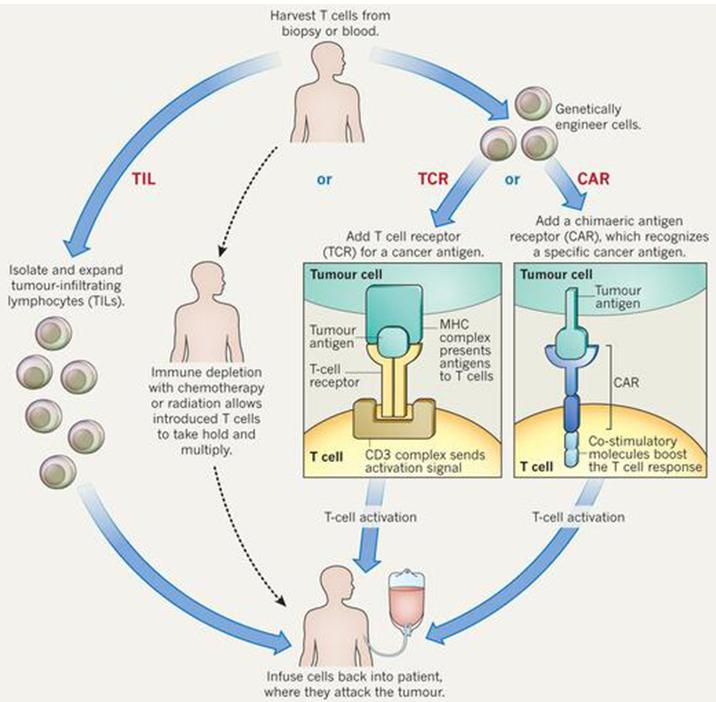
TCR-T是给T细胞转入一个人工T细胞受体(TCR)基因,这个人工TCR是某种能识别患者肿瘤的TCR序列,从而代替天然TCR,行使识别靶细胞的功能。其特点是:
一、MHC(HLA)限制性
TCR-T依赖于人工TCR识别肿瘤,本质上是依赖于肿瘤细胞的MHC蛋白提呈突变的抗原肽,才有可能让TCR识别。对于某种通用的靶点(比如NYESO1)特异的TCR,还需要是特定的MHC(HLA分型)才能适配。所以从这一点来说,TCR-T有着比CAR-T更苛刻的适用范围。
二、靶标位置的非限制性
不同于CAR-T靶标受限于肿瘤膜蛋白,TCR-T可以靶向任何一种“非己”的蛋白,包括胞内的蛋白。从这一点来说,TCR-T比CAR-T有着更广泛的适用人群。
TCR-T可以用于实体瘤,靶向一些正常细胞一般不表达,而肿瘤细胞可能会表达的靶标,比如癌睾抗原如NYESO1。
TCR-T也可以靶向患者个体化的新抗原,其优势在于,但这需要基于新抗原疗法的一系列复杂的靶标筛选,以及得到精准的TCR序列,周期长成本高。
TCR-T的优点在于其机制更接近T细胞的天然机制(依赖TCR),其毒副作用也相对较低。对于MHC-靶点-TCR三者适配的患者,有非常好的效果的报道。比如2017年初《Nature》报道,罗森博格用靶向KRAS 12/13密码子的TCR-T,使“无药可救”的晚期肺癌患者达到CR。
目前还没有TCR-T的细胞治疗产品上市,但可以预期这是一种比较有效的免疫疗法。
三、TCR-T理论上的局限性
固定单靶点的TCR-T具有所有固定单靶点疗法的通用的局限性,肿瘤突变呈现高度异质性,单靶点治疗的效用很难持久,肿瘤会往往会通过“靶点逃逸”而耐药。